Introduction :
La leucémie myéloïde chronique (LMC) est une hémopathie maligne rare faisant partie
des néoplasies myéloprolifératives. Elle est caractérisée par une prolifération clonale
non contrôlée des progéniteurs hématopoïétiques. La leucémie myéloïde chronique est la première hémopathie associée à
une anomalie cytogénétique acquise : la translocation (9 ;22) et son équivalent moléculaire bcr-abl. L’avènement depuis l’année 2000 du traitement moléculaire ciblé par les inhibiteurs de la tyrosine kinase (ITK) a permis d’améliorer spectaculairement le pronostic
de cette hémopathie [1].
Le but de notre travail
est d’étudier les résultats thérapeutiques des patients atteints de LMC traités par ITK de première intention.
Patients et méthodes :
Nous avons inclus dans notre étude les patients atteints de LMC suivis et traités dans le service
d’hématologie de l’hôpital Aziza Othmana
de Tunis entre Janvier
2002 et Décembre 2014. Le diagnostic positif est confirmé par le caryotype médullaire montrant la présence du chromosome Philadelphie et la biologie moléculaire sur un prélèvement médullaire ou sanguin
par technique RT-PCR mettant en évidence le transcrit
bcr-abl. Ces deux examens sont réalisés respectivement aux services de cytogénétique et d’hématologie biologique de l’Institut Pasteur
de Tunis. La phase de la maladie
au diagnostic est classée en chronique, accélérée ou blastique selon les critères de l’European Leukemia Net [1,2].
Les patients diagnostiqués d’emblée en phase blastique ont été exclus de notre étude. La première ligne thérapeutique était l’Imatinib à la dose
journalière de 400 mg en phase
chronique et 600 mg en phase
accélérée. Les patients
ont bénéficié d’un suivi clinique et biologique rapprochés afin d’évaluer la réponse et détecter précocement les effets indésirables. Le monitoring hématologique, cytogénétique et moléculaire ainsi que les définitions des réponses hématologiques, cytogénétiques et moléculaires répondent aux recommandations de l’ELN 2009[2]
pour les patients
traités de 2002 à 2012et de l’ELN 2013[3]
pour ceux traités de 2013 à
2014.
Le traitement de deuxième ligne repose sur l’un
des deux ITK de deuxième génération le Dasatinib
ou le Nilotinib.
La survie globale
(SG) est définie par la période en mois entre la date du diagnostic et la date des dernières nouvelles. La survie sans évènements (SSE) est la période en mois entre la date du début du traitement et la date de l’évènement pouvant être un décès, une rechute hématologique, cytogénétique ou moléculaire ou une progression en phase accélérée ou blastique. La survie sans progression (SSP) est la période en mois ente la date du début du traitement et la date de la progression. Les données ont été analysées à
l’aide du logiciel
SPSS 19.0. Les courbes de SG, SSE et SSP ont été réalisées selon la méthode Kaplan Meier. Une analyse
uni et multivariée de la survie en fonction
de différents facteurs pronostiques était réalisée. Une signification est retenue pour p<0.05.
Résultats :
Nous avons colligé 173 cas de LMC entre 2002 et 2014. L’âge médian de la population était de 45 ans (3-78 ans). Une légère prédominance masculine a été notée avec un sex-ratio
de 1.3. Au diagnostic 91% de nos patients étaient en phase chronique et 9 % en phase accélérée. Le score pronostique de Sokal était élevé chez 50% des patients.
L’Imatinib a permis l’obtention d’une réponse hématologique complète (RHC)
à 3 mois chez 95% des patients. Une
réponse cytogénétique complète (RCyC) a été obtenue chez 70% des patients
avec un délai médian de 6 mois (3- 42). Une réponse moléculaire majeure (RMM) a été obtenue chez 64% des patients avec un délai médian de 18 mois (3-72). 40% des patients ont atteint une réponse moléculaire (RM) >4 log avec un délai médian de 30 mois (6-100). Un passage à un traitement par un ITK de 2ème génération a été effectué chez 40% des patients. Les indications principales étaient l’échec à
l’imatinib (53%), la rechute
(11%) et la réponse sub-optimale (10%)
sous traitement de première ligne.
Le traitement de deuxième ligne a permis l’obtention d’une RMM et d’une RM > 4 log dans respectivement 52 % et 29% des cas.
Entre 2013 et 2014, une évaluation moléculaire précoce selon les critères de l’ELN 2013 a été réalisée chez 20 patients parmi 24 diagnostiqués et traités au cours de cette période. Un ratio bcr-abl≤
10% à 3 mois a été noté chez 60% des patients
(12/20). Parmi les 8 patients ayant gardé un ratio > 10%, 7 patients ont eu un traitement par ITK de deuxième génération à
3 mois. La survenue d’effets indésirables au traitement par ITK a été notée chez 41% des patients dont 40% d’ordre hématologique et 60% extra-hématologique dominés par l’atteinte digestive. Tous les effets
indésirables étaient sans gravité majeure et étaient réversibles à l’arrêt transitoire
de l’Imatinib ou au passage
à un autre ITK. La toxicité a nécessité le changement du traitement chez 5 patients parmi toute la série. Nous avons eu recours à
l’allogreffe de cellules souches hématopoïétique chez 4 patients
de notre série. L’indication de l’allogreffe était la progression en phase avancée chez 3 patients et l’échec des 3 ITK en rapport avec la présence de la mutation T315I chez 1 patient.
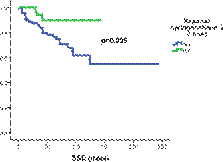
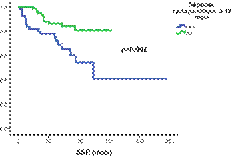
La SG à 5 ans de notre population était de 90% (figure 1). La phase de la maladie au diagnostic (p=0.001), l’obtention d’une RCyC à 12 mois (p=0.002) (figure 2) et la réponse ELN (p=0.002) avaient
un impact significatif sur la SG.
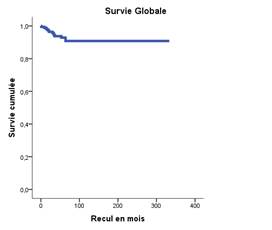
Figure 1: La Survie globale
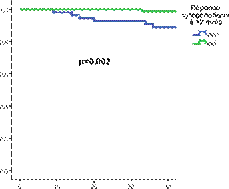
Figure 2 : Impact de la RCyC à 12 mois sur la SG
La SSE à
5 ans était de 76% (figure3).
Les facteurs prédictifs significatifs en termes de SSE étaient la RCyC à
6 mois (p=0.006) (figure 4) et à 12 mois (p=0.002)
(figure
5) ainsi que la RMM à 12 mois (p=0.032) et à 18 mois (p=0.04) et la réponse ELN (p=0.001).

Figure 3 : Survie sans évènement
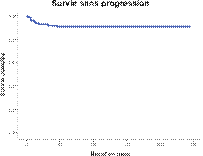
La SSP à
5 ans était de 91% (figure 6). Cette dernière était significativement influencée par la phase de la maladie
au diagnostic (p=0.000), la RCyC à 6 mois (p=0.03) et à
12 mois (p=0.002)
et la réponse ELN (0.002).
(4) (5) (6)
Figure 4 : Impact de la RCyC 6 mois sur la SSE Figure 5 : Impact
de la RCyC 12 mois sur la SSE Figure 6 : Survie sans progression
La LMC représente 15% de toutes les leucémies [4,5]. L’âge médian au diagnostic rapporté dans la littérature est de 65 ans [6]. Notre population est relativement plus jeune avec un âge médian de 45 ans. Nous n’avons pas retrouvé de facteurs de risque potentiels chez nos patients expliquant
l’âge jeune au diagnostic. La prédominance masculine retrouvée dans notre série concorde avec la littérature [7]. Comme
dans notre population, plus de 90% des cas de LMC sont diagnostiqués en phase chronique [8]. L’imatinib 400 mg a reçu l’AMM dans le traitement de la LMC en phase chronique en 2002 suite à la publication de l’étude internationale randomisée IRIS [9]. Nous avons commencé à l’utiliser en Tunisie
dans cette indication la même année. L’étude IRIS a porté sur 1106 cas de LMC nouvellement diagnostiqués, en phase chronique de la LMC. Cette étude a comparé les résultats de l’Imatinib 400 mg par jour par rapport à
l’association Interféron α
et Cytarabine faible dose. Les résultats ont conclu à la supériorité de l’Imatinib en termes de RHC, RCyC et RMM. Nos résultats avec l’Imatinib sont très satisfaisants et rejoignent ceux rapportés dans la littérature [9-11]. Pour les patients résistants ou
intolérants à l’Imatinib,
un
passage à
un ITK de deuxième génération est indiqué. Ces ITK sont plus puissants
et permettent une réponse plus précoce et plus profonde
que l’Imatinib. Dans notre série, les résultats thérapeutiques obtenus
avec les ITK 2 rejoignent ceux rapportés dans la littérature [12-16]. Les études ont montré que les patients
qui présentaient un taux de bcr-abl à 3 mois ≤
10% avaient une meilleure SG et SSP [17]. Cependant
pour un taux de bcr-abl à 3 mois >10%,
l’indication d’un switch précoce à
un ITK2 à 3 mois ou l’attente de la réponse à 6 mois n’est pas encore bien établie. Comparativement avec la majorité des drogues
utilisées dans le traitement
des néoplasies, les ITK sont relativement bien tolérés. La toxicité de L’Imatinib était observée dans 41% de nos cas sans morbidité majeure. Ceci est compatible avec la littérature [18]. Avec l’avènement des ITK, la survie des patients traités pour une LMC rejoint
actuellement celle de la population générale [19]. On parle même de possibilité de « guérison » et d’arrêt du traitement. L’étude STIM (2010) ayant inclus 100 patients traités par Imatinib pendant plus de 5ans avec une réponse moléculaire >5 log maintenue pendant au moins 2 ans. 40% des patients ont maintenu une réponse moléculaire complete
à 1 an d’arrêt du traitement.
Chez les 60% des patients ayant rechuté, la réintroduction de l’Imatinib a permis de nouveau
une réponse moléculaire complète [20]. Depuis,
plusieurs autres études ont évalué l’arrêt des ITK [21-25]. Dans notre pratique, l’arrêt des ITK chez les patients répondant aux critères de l’étude STIM est en cours d’évaluation.
Conclusions :
La leucémie myéloïde chronique, autrefois fatale a vu son pronostic basculer
grâce à l’avènement d’un traitement ciblé par ITK. L’Imatinib reste le traitement standard de la LMC. La cytogénétique et la biologie
moléculaire permettent un suivi précis et efficace
de la réponse au traitement. Les ITK de deuxième génération améliorent les résultats des patients résistants à l’Imatinib sauf pour la mutation
T315i qui nécessite soit un ITK de 3ème génération le Ponatinib
ou la greffe de cellules
souches hématopoïétiques.
Le
monitoring rapproché de la réponse et la détection précoce de la toxicité du traitement
sont les seuls garants
d’une survie sans évènement d’excellente qualité. Nos résultats thérapeutiques sont très encourageants et rejoignent ceux de la littérature.
Conflict of interest:
none
References:
[1]Baccarani M, Saglio G, Goldman J, Hochhaus A, Simonsson
B, Appelbaum F et al. Evolving
concepts in the management of chronic myeloid leukemia: recommendations from an expert panel on behalf
of the European
Leukemia Net. Blood.2006; 108(6):1809-20.
[2]Baccarani M, Cortes J, Pane F, Niederwieser D, Saglio G, Apperley J et al. Chronic myeloid
leukemia: an update of concepts
and management recommendations of European Leukemia Net. J Clin Oncol.2009; 27(35): 6041-51.
[3]Baccarani M, Deininger MW, Rosti G, Hochhaus A, Soverini
S Et al. European Leukemia Net recommendations for the management of chronic myeloid leukemia: Blood.2013; 122(6): 872-84.
[4]Sokal JE, Cox FB, Baccarani M. Prognostic discrimination in good-risk chronic
granulocytic leukemia.
Blood.1984 ;63 :789- 99.
[5]Faderl S, Talpaz M, Estrov Z, O'Brien
S, Kurzrock R, Kantarjian MH. The biology
of chronic myeloid leukemia. N Engl J Med.1999; 341(3):
164-72.
[6]Hehlmann R, A. Hocchaus
A, Baccarani M. Epidemiology of chronic myeloid leukaemia. Lancet.2007; 370: 342-50.
[7]Rohrbacher M, Hasford J. Epidemiology of chronic myeloid leukaemia. Best Pract
Res Clin Haemato.2009; 22:295-302.
[8]Höglund M, Sandin F, Hellström K, Björeman M, Björkholm M, Brune M, et al. Tyrosine kinase inhibitor
usage, treatment outcome,
and prognostic scores in CML: report from the population-based Swedish CML registry.
Blood.2013; 122(7): 1284-92.
[9]O'Brien SG, Guilhot F, Larson RA, Gathmann I, Baccarani
M, Cervantes
F, et al. Imatinib
compared with interferon and low- dose cytarabine for newly
diagnosed chronic-phase chronic myeloid leukemia. N Engl J Med.2003;
348(11): 994-1004.
[10]Jabbour E, Kantarjian HM, Saglio G, Steegmann JL, Shah NP, Boqué C et al. Early response with dasatinib
orimatinib in chronic myeloid
leukemia: 3-year follow-up from a randomized phase 3 trial (DASISION). Blood.2014;123: 494-500.
[11]Hughes TP, Saglio G, Kantarjian HM, Guilhot F, Niederwieser D, Rostiet G al (2014). Early
molecular response predicts
outcomes in patients
with chronic myeloid leukemia in chronic phase treated
with front line nilotinib or imatinib. Blood.2014; 123:1353-60.
[12]Cornelison M, Kantarjian H,
Cortes J, Jabbour
E. Outcome of treatment of CML with 2nd generation tyrosine kinase
inhibitors after Imatinib failure. Clin Lymphoma Myeloma Leuk,.2011;11(1): S101-S110.
[13]Shah NP, Guilhot F, Cortes JE, Schiffer
CA, Coutre P, TH. Brümmendorf TH, et al. Long-term outcome
with dasatinib
after Imatinib failure in chronic-phase chronic myeloid leukemia: follow-up of a phase 3 study. Blood.2014; 123(15): 2317-24.
[14]Okada M, Satake A, Kaida K, Taniguchi K, Yoshihara
S, Ikegame
I et al (2011).
Successful treatment with Nilotinib after Imatinib failure in a CML patient
with a four-way Ph chromosome translocation and point mutations
in BCR/ABL gene. Int J Hematol.2011; 93(2): 243-6.
[15]Kantarjian HM, Giles
FJ, Bhalla KN, Pinilla-Ibarz
J, Larson RA, Gattermann N et al. Nilotinib is effective
in patients
with chronic myeloid leukemia in chronic phase after Imatinib resistance or intolerance: 24-month follow-up results.
Blood.2011 ; 117 :1141-5.
[16]Giles FJ, Le Coutre PD, Pinilla-Ibarz J, Larson RA, Gattermann N, Ottmann OG et al (2013). Nilotinib in imatinib-resistant or imatinib-intolerant patients with chronic myeloid
leukemia in chronic phase: 48-month follow-up results of a phase II study.
Leukemia.2013; 27(1): 107-12.
[17]Marin D, Ibrahim AR, Lucas C, Gerrard G, Wang L, Szydlo RM, et al. Assessment of BCR-ABL1
transcript levels
at 3 months is the only requirement for predicting outcome
for patients with chronic myeloid leukemia treated with tyrosine kinase inhibitors. J Clin Oncol.2012; 30: 232-8.
[18]Mughal TI, Schrieber A. Principal
long-term adverse effects of imatinib
in patients with chronic
myeloid leukemia in chronic
phase. Biologics.2010; 4: 315-23.
[19]Bower H, Björkholm M, Dickman PW, Höglund M, Lambert
PC, Andersson TM. Life expectancy of patients
with chronic myeloid leukemia approaches the life expectancy of the general
population. J Clin Oncol.2016
; 34(24): 2851- 57.
[20]Mahon FX, Réa D, Guilhot
J, Guilhot F, Huguet F, Nicolini
F, et al. Discontinuation of imatinib in patients with chronic myeloid leukaemia
who have maintained complete molecular remission for at least 2 years:
the prospective, multicentre Stop Imatinib (STIM) trial. Lancet Oncol.2010; 11(11): 1029-35.
[21]Yhim HY, Lee NR, Song EK, Yim CY, Jeon
SY,
Lee B, et al. Long-term outcomes after Imatinib Mesylate discontinuation in chronic myeloid leukemia patients with undetectable minimal residual disease. Acta Haematol.2016
; 135(3): 133-9.
[22]Mahon FX, Nicolini
FE, Noël MP, Escoffre M, Charbonnier A, Rea D, et al. Preliminary report of the STIM2 study:
A multicenter stop Imatinib
trial for chronic phase chronic
myeloid leukemia De Novo patients on Imatinib. Blood.2013;122(21): 654.
[23] Ross DM, Branford S, Seymour JF, Schwarer AP, Arthur
C, Yeung DT, et al. Safety
and efficacy of imatinib
cessation for CML patients with stable undetectable minimal residual disease: results
from the TWISTER study. Blood.2013; 122(4): 515-22.
[24]Mahon FX, Richter J, Guilhot J, Muller MC, Dietz C, Porkka K, et al. Interim analysis of a Pan European Stop Tyrosine
Kinase Inhibitor Trial in chronic myeloid leukemia: The EURO-SKI study. Blood.2014, 124 :151.
[25]Rea D, Nicolini
FE, Tulliez M, Rousselot P, Guilhot F, Gardembas M, et al. Dasatinib or Nilotinib
Discontinuation in chronic phase (CP)-chronic myeloid leukemia (CML) patients (pts)
with durably undetectable BCR-ABL transcripts:
interim analysis of the STOP 2G-TKI study with a minimum follow-up of 12 Months – on Behalf of the French CML Group. Blood.2014; 124:811.







